그만큼 헤모글로빈 합성 헴 합성과 글로빈 합성으로 구성됩니다. 마지막으로, 각각 4 개의 글로빈을 가진 보철 헴 그룹은 철 함유 단백질 복합체 헤모글로빈과 연결됩니다. 헴 합성과 글로빈 합성의 장애는 심각한 건강 문제로 이어질 수 있습니다.
헤모글로빈 합성이란 무엇입니까?

헤모글로빈 합성을 이해하기 위해서는 먼저 헤모글로빈의 구조에 대한 지식이 필요합니다. 헤모글로빈은 철분 함유 단백질 복합체로, 각각 보철 헴 그룹이있는 4 개의 글로빈 하위 단위로 구성됩니다.
인간 성인 헤모글로빈에는 두 개의 동일한 알파 글로빈과 하위 단위로 두 개의 동일한 베타 글로빈이 있습니다. 이러한 각 서브 유닛은 포르피린 철 (II) 복합체로 구성된 보철 헴 그룹에 결합되어 있습니다. 따라서 헤모글로빈 복합체는 4 개의 헴 그룹을 포함합니다.
화학적 환경에 따라 각 헴 그룹은 복잡한 방식으로 산소 분자를 철 이온에 결합 할 수 있습니다. 얼마나 많은 헴 그룹에 산소가 적재되었는지에 따라 옥시 헤모글로빈 (산소가 높음) 또는 데 옥시 헤모글로빈 (산소가 낮음)이 있습니다.
철 이온은 포르피린 고리의 중간에 있습니다. 측면에는 글로빈의 히스티딘 잔기에 복잡한 결합이 있습니다. 반면에 철 이온의 에너지 상태에 따라 산소 분자가 복합체로 결합 될 수 있습니다. 에너지 상태는 글로빈 형태의 변화로 인해 외부 물리적 및 화학적 조건의 영향을받습니다.
기능 및 작업
헤모글로빈 합성의 마지막 단계는 보철 헴 그룹을 4 개의 글로빈 단위로 조립하여 철 함유 단백질 복합체를 형성하는 것입니다. 개별 구성 요소는 독립적 인 생합성 경로에 의해 형성됩니다.
헴 그룹의 포르피린 고리의 출발 물질은 아미노산 글리신과 숙시 닐 -CoA입니다. 숙시 닐 -CoA는 코엔자임 A와 숙신산으로 구성됩니다. 숙신산은 에너지 대사의 일부로 에너지가 풍부한 케톤체를 분해하는 중간 생성물입니다. delta-aminolevulinic acid synthase 효소의 도움으로 delta-aminolevulinic acid는 succinyl-CoA와 glycine에서 합성됩니다. 델타-아미노 레 불린 산의 두 분자는 물 한 분자의 제거와 함께 응축되어 피롤 유도체 포 르포 빌리 노겐을 형성합니다. 암모니아를 제거하고 효소 uroporphyrinogen-I synthetase의 도움으로 4 분자의 porphobiliogen이 반응하여 hydroxymethylbilane을 형성합니다. 이것은 고리 형성과 함께 uroporphyrinogen III로 변환됩니다.
프로토 포르피린은 미토콘드리아에서 효소 탈 카르 복 실화 및 탈수를 통해 생성됩니다. 효소 ferrochelatase를 사용하면 철 (II) 이온이이 분자에 통합되어 헴이 형성됩니다. 세포의 세포질에서 헴은 단백질 글로빈과 연결되어 철 함유 단백질 복합체 헤모글로빈을 형성합니다.
개별 글로빈의 합성은 정상적인 단백질 생합성을 통해 이루어집니다. 이미 언급했듯이 성인 헤모글로빈 복합체는 알파 및 베타 글로빈의 두 개의 동일한 하위 단위를 포함합니다. 복잡한 구조로 인해 완성 된 헤모글로빈은 산소를 운반하고 유기체의 모든 세포에 공급하는 능력을 개발했습니다.
그러나 중앙 철과 산소의 결합은 그다지 단단하지 않으며 외부 화학적 및 물리적 요인에 의해 매우 쉽게 영향을받을 수 있습니다. 이것은 헤모글로빈이 산소를 빠르게 흡수하고 방출하도록합니다. 헤모글로빈의 산소 함량은 무엇보다도 pH, 이산화탄소 또는 산소 분압 또는 온도 요인에 따라 달라집니다. 이러한 영향을 미치는 변수는 예를 들어 글로빈의 적합성을 변경하여 에너지 및 입체 조건의 약간의 변화로 산소 결합을 강화하거나 약화시킬 수 있습니다.
pH 값이 낮고 이산화탄소 분압이 높으면 철 (II) 이온에 대한 산소 결합이 약해져 산소 방출이 선호됩니다. 정확히 이러한 조건 하에서 더 강한 대사 전환이 일어나고 산소 요구량이 증가합니다. 따라서 산소 수송 시스템은 헤모글로빈 기능을 통해 신체적 필요에 맞게 최적으로 조정됩니다.
질병 및 질병
헤모글로빈 합성 장애는 다양한 질병으로 이어질 수 있습니다. 헴 합성의 중단에 기초한 여러 유전 질환이 있습니다. 이 과정에서 헴 전구체가 몸에 축적되어 무엇보다도 빛에 대한 극도의 민감성을 유발합니다. 이러한 소위 포르피린증에서 포르피린은 혈관이나 심지어간에 저장됩니다. 빛에 노출되면 일부 형태의 포르피린증은 더 많은 복사 에너지를 저장합니다. 에너지가 방출되면 노출 된 조직을 공격하고 파괴하는 산소 라디칼이 생성됩니다. 이것은 심한 가려움증과 타는듯한 통증을 유발합니다.
반암에는 7 가지 형태가 있습니다. 헴의 구성은 7 개의 효소가 관여하는 8 단계 과정입니다. 효소가 부적절하게 기능하는 경우 각 전구체는 헴 합성의이 시점에 저장됩니다. 증상에 따라 포르피린증은 두 가지 주요 그룹으로 나뉩니다. 소위 피부 포르피린증은 빛에 대한 피부의 고통스러운 민감성이 특징입니다. 간 포르피린증에서 간 침범은 심한 복통, 메스꺼움 및 구토를 동반합니다. 그러나 대부분의 경우 두 증상 복합물 사이에 겹치는 부분이 있습니다.
포르피린증은 종종 급성 발작과 함께 간헐적 인 과정을 보입니다. 포르피린증의 유형에 따라 이들은 갑작스런 피부 반응, 산통과 같은 복통, 메스꺼움 / 구토, 소변의 붉은 색, 발작, 신경 학적 결손 또는 정신병으로 나타납니다.
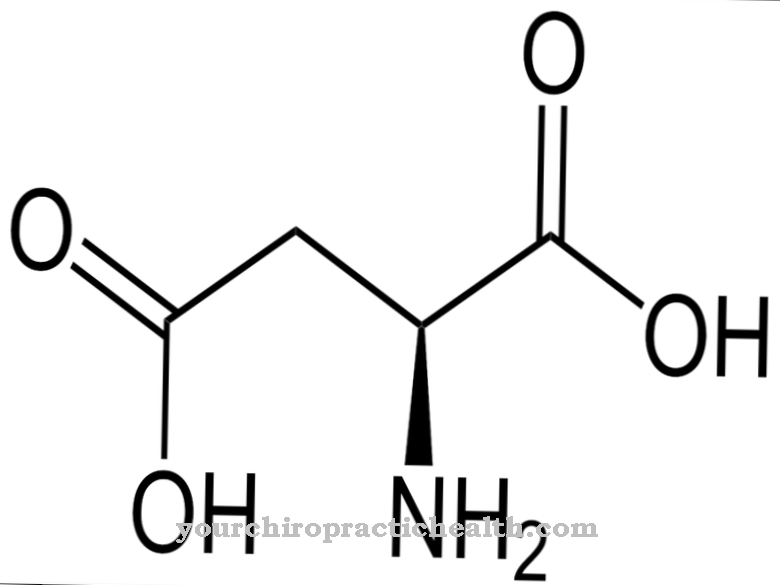
헤모글로빈 합성의 다른 장애는 해당 유전자의 돌연변이를 통한 글로빈 분자의 잘못된 합성과 관련이 있습니다. 예를 들어 소위 겸상 적혈구 빈혈 또는 지중해 빈혈이 있습니다. 겸상 적혈구 빈혈에서 베타 글로빈 소단위의 단백질은 유 전적으로 변형됩니다. 이 단백질의 위치 6에서 아미노산 글루탐산이 발린으로 대체되었습니다. 산소가 부족하면 관련 헤모글로빈이 낫 모양이되어 서로 뭉쳐서 작은 혈관을 막습니다. 이것은 생명을 위협하는 순환계 장애를 초래합니다. 지중해 빈혈은 알파 또는 베타 글로빈의 글로빈 사슬 형성을 감소시키는 여러 헤모글로빈 기형의 그룹입니다.심한 빈혈이 가장 중요한 증상입니다.







.jpg)