그만큼 유도 적합-이 이론은 Koshland로 돌아가서 해부학 적 구조의 적합도에 기반한 키 잠금 원리의 확장에 해당합니다. Induced-fit은 효소-리간드 복합체를 형성하기 위해 형태를 바꾸는 키나아제와 같은 효소를 말합니다. 효소 결함의 경우 유도 된 적합 원리는 장애의 영향을받을 수 있습니다.
유도 적합성이란 무엇입니까?

신체의 많은 프로세스가 키 잠금 또는 손에 끼는 장갑 원칙에 따라 작동합니다. 예를 들어, 이는 관절 연결에 적용됩니다. 조인트 헤드는 자물쇠의 열쇠 또는 장갑의 손처럼 조인트 소켓에 맞물립니다. 열쇠가 정확히 자물쇠에있을 때만 문이 열립니다. 같은 맥락에서 신체의 특정 기능은 구조가 정확하게 만나야 만 열립니다.
인덕 티드 핏은 키-인-락 원리의 특별한 형태입니다. 이것은 단백질-리간드 복합체, 예를 들어 효소-촉매 반응의 맥락에서 효소-기질 복합체의 형성에 대한 이론입니다.
Daniel E. Koshland는 이론을 처음으로 설명한 사람으로 간주되어 1958 년에 처음으로 가정했습니다. 키 잠금 원리와 달리 유도 맞춤 이론은 두 개의 정적 구조를 가정하지 않습니다. 특히 단백질-리간드 복합체의 경우 관련된 단백질의 구조적 변화로 인해 복합체가 형성 될 수 있습니다. 리간드와 단백질, 또는 오히려 효소 인 Koshland는 역동적 인 것으로 간주하고 복잡한 형성을 위해 두 파트너를 구조 변화로 이동시키는 상호 작용에 대해 말했습니다.
기능 및 작업
효소와 기질 사이에는 결합 특이성이 있습니다. 이 결합 특이성은 키 잠금 원리를 의미합니다. 각 효소에는 활성 중심이 있습니다. 리간드와의 복잡한 형성의 경우이 중심은 의도 된 기판의 공간적 모양과 거의 완벽하게 일치하는 방식으로 정밀하게 형성됩니다.
그러나 많은 효소의 경우 각 경우의 활성 중심은 기질에 결합되지 않는 한 매우 정확하지 않은 형태입니다. 이 관찰은 효소와 그 리간드가 처음에 그 모양에 적응하는 것처럼 보이기 때문에 잠금 및 키 원리와 모순되는 것처럼 보입니다.
효소가 리간드에 부착 되 자마자 분자간 상호 작용이 생성됩니다. 분자간 수준에서 이러한 상호 작용은 효소의 형태를 변화시킵니다. 형태는 축 주위의 단순한 회전으로 인해 분자 내 개별 원자의 다양한 가능한 배열을 의미하는 것으로 이해됩니다. 효소 구조의 변화는 분자의 공간적 배열 변화에 해당하며 효소-기질 복합체의 형성 만 가능하게합니다.
효소로서의 헥소 키나아제는 예를 들어 해당 과정의 첫 번째 단계를 촉매합니다. 이들 효소가 기질 포도당과 접촉하자마자 "유도 된 적합"의 형성이라는 의미에서 유도 된 적합이 관찰 될 수있다. 효소 헥소 키나아제는 ATP를 소비하여 포도당 -6- 인산을 형성함으로써 리간드 포도당을 인산화합니다.
물의 구조는 C6 원자의 알코올 그룹 내에서 효소가 반응 중에 인산화되는 구조와 유사합니다. 크기가 작기 때문에 물 분자가 효소의 활성 중심에 부착되어 ATP의 가수 분해가 생성 될 수 있습니다. 그러나 유도 된 맞춤은 헥소 키나제가 높은 특이 도로 포도당 전환을 촉매 할 수있게하여 ATP 가수 분해가 약간 발생해야합니다. 유도 맞춤 메커니즘을 사용하면 기질 특이성이 증가합니다.
인간 유기체 내의 원리는 특히 키나제의 경우에 관찰 될 수 있습니다. 유도 된 적응은 모든 리간드-수용체 복합체에 적용되지는 않습니다. 두 파트너의 구조적 변화는 많은 경우 자연적인 한계이기 때문입니다.
질병 및 질병
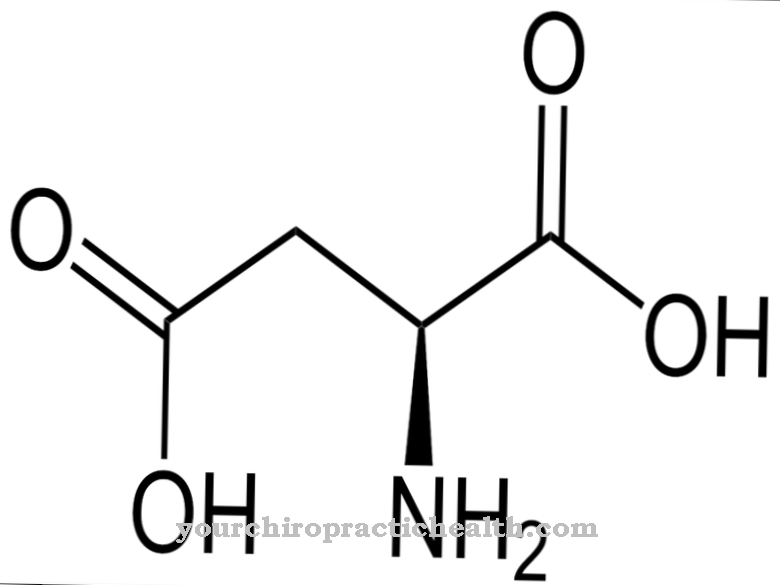
유도 적합 원리는 다른 효소 결함의 경우 방해받습니다. 예를 들어, 페닐 케톤뇨증에서 효소는 활동이 제한되거나 완전히 실패합니다. 일반적으로 이것은 유전 적 결함 때문입니다. 페닐 케톤뇨증에서 효소 페닐알라닌 하이드 록 실라 제에 결함이 있습니다. 페닐알라닌은 더 이상 티로신으로 전환되지 않고 그에 따라 축적됩니다. 신경 독성 물질이 발생하여 정신 장애 외에도 환자가 경련하는 경향이 있습니다. 효소 결함은 일반적으로 유전 적이며 DNA에서 잘못 코딩 된 아미노산 서열로 인해 발생합니다.
효소 결함 및 그러한 방해 유도 적합 원리로 인한 대사 질환을 효소 병증이라고합니다. 피루 베이트 키나제 결함은 예를 들어 잘못 코딩 된 PKLR 유전자에 존재합니다. 이 유전자는 염색체 1의 유전자 좌위 1q22에 위치합니다. pyruvate kinase의 PKLR 대립 유전자의 다양한 돌연변이가 알려져 있으며, 이는 R 형태의 결함으로 나타납니다.
Hers 질병은 다시 글리코겐 증 VI 형으로 불리며 글리코겐 축적 질병 그룹에 속합니다. 효소 결함으로 인한 상 염색체 열성 또는 X- 연관 대사 장애입니다. 보다 정확하게는 간과 근육 내의 포스 포 릴라 제 키나제 시스템의 다양한 효소 결함에 원인이 있습니다. 이러한 맥락에서, 예를 들어, 간에서의 X- 연결 포스 포 릴라 제 -b- 키나제 결함, 상 염색체 열성 유전의 간 포스 포 릴라 제 결함 및 간 및 근육 내에서 포스 포 릴라 제 -b- 키나제의 결합 실패가 알려져있다.
간 인산화 효소와 관련하여 원인 돌연변이는 PYGL 유전자에 국한되어 있으므로 염색체 14q21 ~ q22에 있습니다. 결합 된 간 근육 포스 포 릴라 제 결핍은 16q12-q13 유전자좌에서 PHKB 유전자의 돌연변이와 관련이 있습니다. 유전자좌 Xp22.2-p22.1상의 PHKA2 유전자의 인과 적 돌연변이는 간 인산화 효소 키나아제의 X- 연결 결함에 대해 확인되었습니다. 다른 글리코 게 노스는 또한 해당 키나제의 유도 된 적합 효과를 상쇄하거나 더 어렵게 만들 수 있습니다.






.jpg)