생 촉매 아황산염 산화 효소 아미노산 분해에서 독성 황 화합물을 무독성 황산염으로 전환시킵니다.
그것은 필수적이므로 모든 유기체에서 발생합니다. 유전 적 결함으로 인해 기능이 방해를 받으면 아황산염 산화 효소 결핍이 발생합니다. 혈중 아황산염 함량이 지나치게 높으면 건강한 환자에게도 부정적인 영향을 미칠 수 있습니다.
아황산염 산화 효소는 무엇입니까?
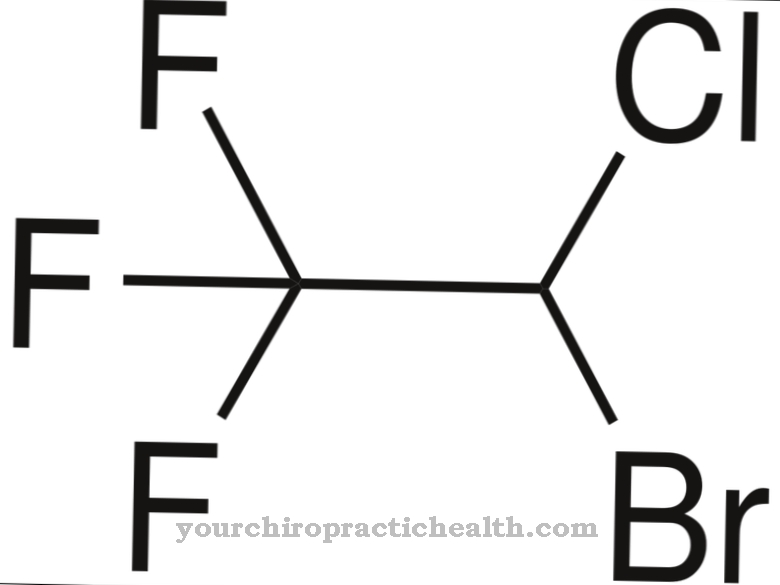
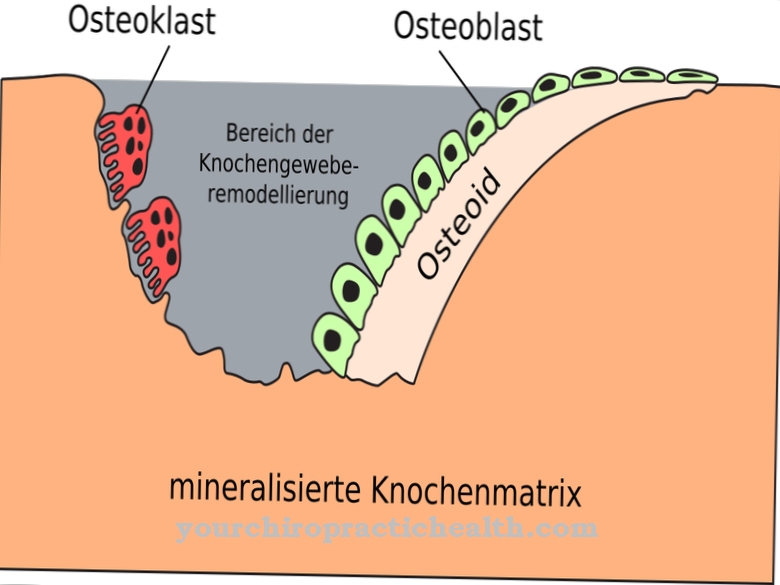
아황산염 산화 효소 (유전자 명 : SUOX)는 466 개의 아미노산으로 구성된 몰리브덴 함유 효소의 이름입니다. 크 산틴 탈수소 효소 계열에 속하며 거의 모든 유기체에서 발생합니다. 중앙에는 필수 미량 원소 인 몰리브덴이 들어 있습니다.
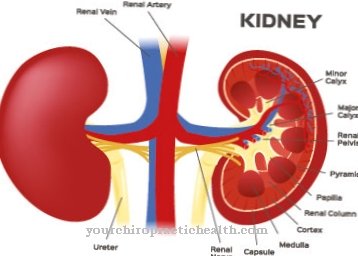
금속은 몰 리브 데이트 음이온으로 생체 이용 가능한 형태로 발생합니다. 아황산염 산화 효소는이를 보조 인자 (몰 리브 데이트-몰 리브도 테린 화합물)로 사용합니다. 효소는 음식을 통해 섭취되는 황 함유 아미노산 인 메티오닌, 시스테인 등을 무해한 황산염 (황산염)으로 전환하여 소변으로 배출합니다. 포유류에서 황 분해 생 촉매는 주로 간과 신장에서 발생합니다. 아황산염 산화 효소 효소는 혈액 산소가 필수 아미노산 및 기타 유황 물질과 결합되도록합니다.
방출 된 전자는 전자 수송 사슬을 통해 ATP (adenosine triphosphate)를 생성하는 데 사용됩니다. 이 효소는 매일 1 리터의 알코올에서 발견되는 아황산염의 10 배를 촉매합니다.
기능, 효과 및 작업
누구나 매일 유황 함유 단백질과 식품 첨가물을 섭취합니다. 후자는 절인 야채, 자몽 주스 등에 포함되어 있으며 미생물의 침입과 변색으로부터 식품을 보호하기위한 것입니다. 그들은 와인에서 꽃다발 물질을 형성합니다.
시스테인이 단독으로 분해되면 매일 신체에 1680mg의 독성 아황산염이 생성되며, 이는 장기와 조직이 손상되지 않도록 아황산염 산화 효소에 의해 즉시 전환되어야합니다. 효소는 다른 생 촉매와 함께 작용합니다. 아황산염은 유독하며 체내의 필수 물질을 파괴 할 수 있으며 소량이라도 필요한 대사 과정을 억제 할 수 있습니다. 세포의 중요한 해독을 수행하려면 아황산염 산화 효소에 미량 원소 몰리브덴이 필요합니다.
이 금속이 부족하면 심각한 결과를 초래할 수 있습니다. 체내의 수은 수치가 너무 높으면 아황산염 산화 효소의 기능도 억제 될 수 있습니다.
교육, 발생, 속성 및 최적의 가치
아황산염 산화 효소는 주로 세포의 "에너지 센터"인 미토콘드리아에서 생성됩니다. 예를 들어 쥐의 경우 80 %가 간세포 미토콘드리아에서 발생합니다. 또한 신장 세포에서 여전히 강력하게 나타납니다.
아황산염 산화 효소의 활성에 필요한 산화 몰리브덴은 효소의 활성 중심에 있습니다. 최근 과학자들이 발견했듯이, 삼산화 몰리브덴 나노 입자는 몰리브덴 결핍 환자에서이를 대체 할 수 있습니다. 그들은 천연 효소와 유사한 촉매 효과를 신체에 가지고 있습니다. 이러한 방식으로 설포 시스테인 뇨증과 같은 이전에 치명적인 질병을 치료할 수 있습니다.
질병 및 장애
아황산염 산화 효소의 결핍은 부교감 신경계가 알레르기 발생을 담당하는 비만 세포에 영향을 미치기 때문에 건강한 사람에게 천식 및 아나필락시스 반응을 일으킬 수 있습니다.
또한 아황산염 산화 효소 수치가 너무 낮 으면 심한 피로감, 두통 및 낮은 혈당 수치로 이어질 수 있습니다. 필수 효소의 유전 적 결핍은 더욱 심각한 결과를 초래합니다. 신생아는 신체적 기형과 정신적 장애를 가지고 태어납니다. 소위 설 파이트 산화 효소 결핍 또는 설포 시스테인 뇨증은 약 100,000 ~ 500,000 명의 출생에서 몰리브덴 보조 인자 (MoCo) 결핍 질환으로 발생합니다. 고립 된 아황산염 산화 효소 결손을 앓고있는 영아는 중증 뇌병증, 간신히 조절할 수있는 발작, 경련, 소두증, 근육 이완 및 진행성 뇌 위축과 같은 유사한 증상을 보입니다.
상 염색체 열성 유전 효소 결핍 질환은 현재 효과적으로 치료할 수 없기 때문에 작은 환자는 보통 어린 시절에 사망합니다. 유황 화합물은 중추 신경계의 수초와 독 뉴런을 분해하지 않고 세포 조직에 축적됩니다. 이미 출생 후 위 내용물을 먹고 구토하는 데 문제가 있습니다. 유아는 변형 된 두개골 (이마 돌출, 깊은 눈, 지나치게 긴 눈꺼풀, 두꺼운 입술, 작은 코)을 가지고 태어납니다. 생후 첫 달 동안 렌즈는 눈에서 움직입니다.
지금까지 설명한 설포 시스테인 뇨증 사례의 약 75 %는 MoCo 결핍으로 인해 발생합니다. 체내 황 분해에 관여하는 세 가지 효소 인 설 파이트 산화 효소, 크 산틴 산화 효소 및 알데히드 산화 효소는 모두 활성이 크게 감소합니다. 분리 된 설 파이트 산화 효소 결핍의 원인은 SUOX 유전자 (염색체 12)의 돌연변이 때문입니다. A 형 (MOCS1 유전자의 돌연변이), B 형 (MOCS2 유전자) 및 C 형 (MOCS3 유전자)의 세 가지 변종으로 나타납니다. A 형 돌연변이가 가장 흔합니다. 전구체 분자 cPMP의 형성이 억제됩니다. 그러나이 물질은 이제 실험실에서 제조 및 관리 할 수 있습니다.소아 환자의 생존율을 높이기 위해서는 가능한 한 빨리 결핍증을 진단하고 매일 몰 리브 데이트를 정맥 내 투여하여 치료해야합니다.
이런 식으로 적어도 추가 손상을 억제 할 수 있습니다. 발작과 싸우기 위해 아이에게 진경제를 투여합니다. 또한 저 단백 식단을 섭취해야합니다. 대안 적으로, MoCo 전구체 Z도 투여 될 수있다. 발작을 줄이고 추가 뇌 손상을 예방합니다. 의학은 몸에서 아황산염 산화 효소의 역할을하는 삼산화 몰리브덴 나노 입자로 이전에 치료할 수 없었던 질병을 치료할 수있는 큰 희망을 가지고 있습니다. 태아에게 아황산염 산화 효소 결핍이 있는지 알아보기 위해 임산부는 양수의 S- 설포 시스테인 수치를 확인할 수 있습니다.

.jpg)



.jpg)

.jpg)
.jpg)



.jpg)