그만큼 수소 결합 Van der Waals 상호 작용과 유사하고 인체에서 발생하는 분자 간의 상호 작용입니다. 결합은 특히 단백질의 펩타이드 결합 및 아미노산 사슬과 관련하여 역할을합니다. 수소 결합과 결합하는 능력이 없으면 유기체는 필수 아미노산이 부족하기 때문에 생존 할 수 없습니다.
수소 결합이란?

수소 결합은 수소 결합 또는 H 브리지 약어. 공유 결합 된 수소 원자와 원자 그룹 원자의 자유 전자 쌍의 매력적인 상호 작용과 관련된 화학적 효과입니다. 상호 작용은 극성을 기반으로하며,보다 정확하게 설명하면 아미노 또는 하이드 록실 그룹의 양극화 된 수소 원자와 다른 작용 그룹의 고독한 전자 쌍으로 구성됩니다.
상호 작용은 특정 상황에서만 발생합니다. 한 가지 조건은 자유 전자 쌍의 전기 음성 특성입니다. 이 속성은 강한 결합을 만들기 위해 수소의 전기 음성 속성보다 강해야합니다. 따라서 수소 원자는 극성이 될 수 있습니다. 전자 음성이없는 원자는 예를 들어 질소, 산소 및 불소 일 수 있습니다.
수소 결합은 2 차 원자가 결합으로, 그 강도는 일반적으로 공유 결합 또는 이온 결합의 강도보다 훨씬 낮습니다. 수소 결합의 분자는 몰 질량과 관련하여 상대적으로 높은 융점과 비슷한 높은 비점을 가지고 있습니다. 결합은 주로 유기체 내의 펩타이드 및 핵산과 관련하여 의학적 관련성이 있습니다.
수소 결합은 분자간 힘입니다. 그들의 존재가 없다면 물은 다양한 응집 상태에 존재하지 않을 것이지만 기체 상태 일 것입니다.
기능 및 작업
수소 결합은 약한 상호 작용만을 가지며 두 입자 사이 또는 분자 내에서 발생합니다. 이러한 맥락에서 결합의 유형은 예를 들어 단백질에서 3 차 구조를 형성하는 역할을합니다. 생화학에서 단백질 구조는 단백질 또는 펩티드의 다양한 구조 수준을 의미합니다. 이러한 자연 발생 물질의 구조는 계층 적으로 1 차 구조, 2 차 구조, 3 차 구조 및 4 차 구조로 구분됩니다.
아미노산 서열은 기본 구조입니다. 단백질이 공간적 배열과 관련하여 언급 될 때마다 단백질 형태 및 형태 변화 현상이 종종 언급됩니다. 이러한 맥락에서 형태의 변화는 공간 구조의 변화에 해당합니다. 단백질의 배열은 펩티드 결합을 기반으로합니다. 이러한 유형의 결합은 항상 같은 방식으로 아미노산을 연결합니다.
세포에서 펩티드 결합은 리보솜에 의해 매개됩니다. 각 펩티드 결합은 물의 제거와 관련된 하나의 아미노산의 카르복실기와 두 번째 아미노산의 아미노기의 연결에 해당합니다. 이 과정을 가수 분해라고도합니다.
모든 펩티드 결합에서 단일 결합은 C = O 그룹과 NH 그룹을 연결합니다. 질소 원자는 정확히 하나의 고독한 전자 쌍을 가지고 있습니다. 산소의 높은 전기 음성도 때문에이 자유 쌍은 O2 원자의 전자를 끌어 당기는 영향을받습니다. 이런 식으로 산소는 고독한 전자 쌍을 질소 원자와 탄소 원자 사이의 결합으로 부분적으로 끌어 당기고 펩티드 결합은 부분 이중 결합 특성을 얻습니다. 이중 결합 특성은 NH 및 C = O 그룹의 자유 회전을 제거합니다.
펩타이드 결합의 산소 원자와 수소 원자는 예외없이 모든 펩타이드와 단백질의 구조 형성과 관련이 있습니다. 이런 식으로 두 개의 아미노산이 서로 붙을 수 있습니다. 이러한 부착 후 두 아미노산 사슬의 모든 펩타이드 결합은 서로 직접적으로 반대됩니다. 펩타이드 결합의 수소 원자는 바로 반대편 펩타이드 결합의 산소 원자와 비교할 때 상대적으로 양극화됩니다. 이런 식으로 수소 결합은 두 아미노산 사슬을 형성하고 서로 연결합니다.
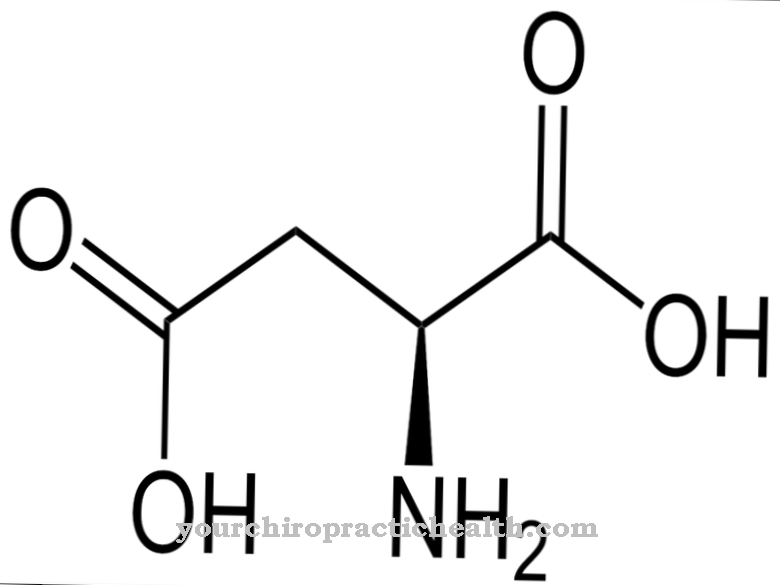
인체의 모든 아미노산은 적어도 하나의 카르복시 그룹과 하나의 아미노 그룹으로 구성된 유기 화합물입니다. 아미노산은 인간 생활의 필수 구조 구성 요소입니다. 단백질의 α- 아미노산 외에도 수소 결합 없이는 생성 할 수없는 생물학적 기능을 가진 400 개 이상의 비 단백질 생성 아미노산이 알려져 있습니다. 수소 결합과 같은 힘은 아미노산의 3 차 구조를 안정화시킵니다.
여기에서 약을 찾을 수 있습니다.
➔ 근쇠약 치료제질병 및 질병
기능적 단백질 성 공간 구조의 형성에 장애가있는 경우 일반적으로 단백질 접힘 장애를 말합니다. 그러한 상태 중 하나가 헌팅턴병입니다. 이 유전병은 상 염색체 우성 형질로 유전되며 4 번 염색체의 유전 적 돌연변이 때문입니다.이 돌연변이는 유전자 산물의 불안정성을 초래합니다. 이 질환은 주로 말단 사지 및 얼굴의 비자발적 과다 운동과 관련된 신경 학적 질환입니다. 지속적인 과다 운동은 영향을받은 근육의 경직으로 이어집니다. 또한 질병에 걸린 환자는 에너지 소비 증가로 고통 받고 있습니다.
수소 결합 또는 일반적인 단백질 구조와 관련된 병리학 적 증상은 광우병과 같은 프리온 질병에도 나타납니다. 가장 인기있는 가설은 BSE가 단백질 잘못된 접힘을 유도한다는 것입니다. 이러한 잘못 접힌 단백질은 생리적 과정에 의해 분해 될 수 없으므로 조직, 특히 중추 신경계에 축적됩니다. 결과는 신경 세포의 퇴화입니다.
단백질 구조의 기형은 알츠하이머 병의 인과 관계에서도 논의되고 있습니다. 언급 된 질병은 수소 결합에 직접적인 영향을주지는 않지만 수소 결합이 중요한 기여를하는 단백질의 공간 구조와 관련이 있습니다.
절대 수소 결합이 불가능한 유기체는 생존 할 수 없습니다. 이를 유발하는 돌연변이는 임신 초기에 낙태를 초래합니다.




.jpg)