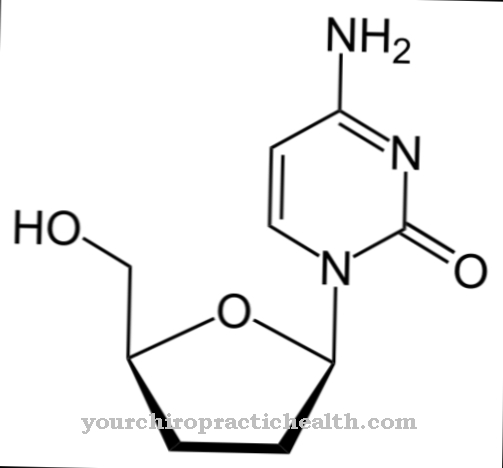
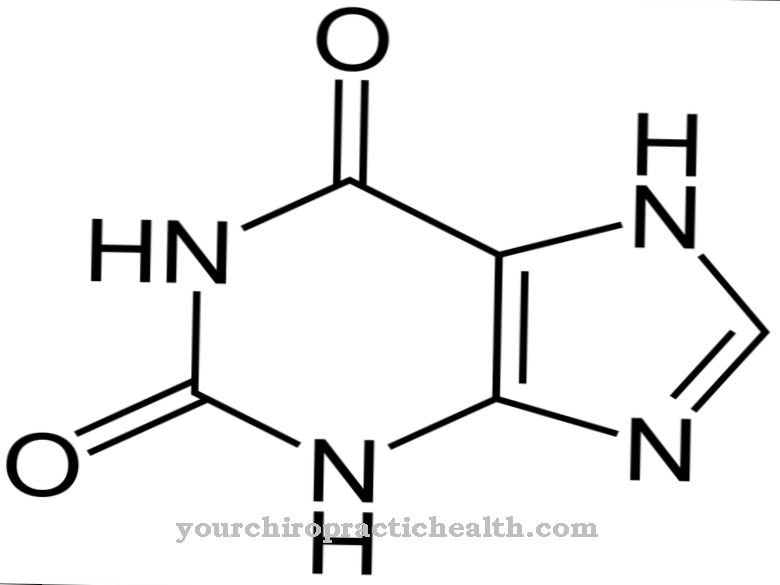
알라닌 단백질 합성을위한 빌딩 블록 역할을하는 비 필수 단백질 생성 아미노산입니다. 그것은 키랄 화합물이며 L- 형태 만이 단백질에 포함될 수 있습니다. 알라닌은 아미노산과 탄수화물 대사 사이의 연결 고리 역할을합니다.
알라닌이란?
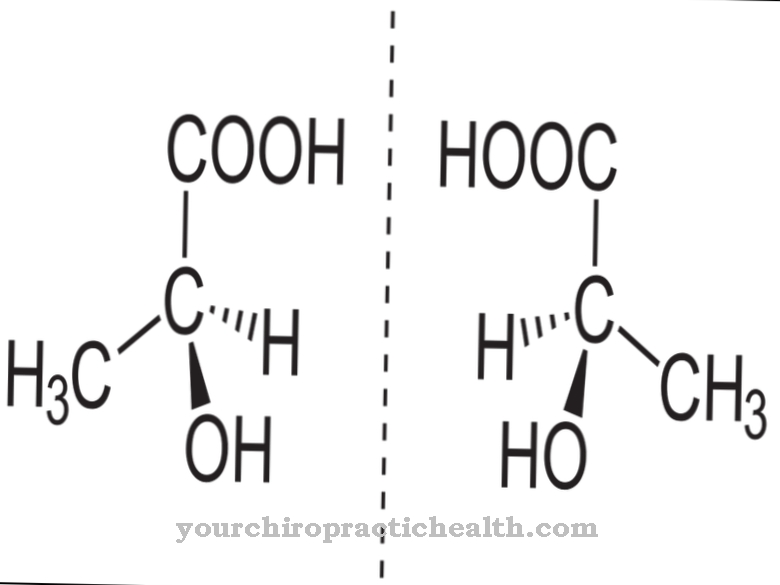
알라닌은 단백질 생성 아미노산으로 인간 유기체에 의해 합성 될 수 있으므로 필수는 아닙니다. 알라닌으로 알려진 아미노산은 실제로 알파 -L- 알라닌이라고합니다. 이 이름에서 카르복실기에 대한 아미노기의 위치가 명확 해집니다.
또한 단백질 합성에는 L 형태의 알라닌 만 사용됩니다. D- 형태는 박테리아 세포막을 형성하는 뮤 레인의 합성을 위해 박테리아에 의해 사용됩니다. 이 맥락에서 또 다른 아미노산은 베타-알라닌입니다. 여기서 아미노기는 베타 탄소 원자에 있습니다. 베타-알라닌은 단백질 생성 아미노산이 아닙니다. 그러나 그것은 또한 생물학적 과정에서 중요한 역할을합니다. 그러나 여기에서 알라닌이 언급되면 항상 알파 -L- 알라닌입니다.
알라닌은 질소 원자에 양의 중심을 가지고 카르복실기의 산소 원자에 음의 중심을 가지고 있습니다. 따라서 알라닌은 양쪽 성 이온을 나타내며, pH 6.1의 알라닌 등전점에서는 거의 모든 분자가 양쪽 성 이온으로 존재합니다. 따라서 수용성은 이러한 조건에서 가장 낮습니다. 그러나 알라닌은 친수성 아미노산이며이 특성을 통해 단백질의 2 차 및 3 차 구조도 결정합니다.
기능, 효과 및 작업
알라닌의 가장 중요한 기능은 단백질 구성의 기본 구성 요소로 관여하는 것입니다. 알라닌의 구조는 단백질의 알파 나선에서 우선적으로 나타납니다. 아미노산 글루탐산 또는 류신과 함께 알라닌은 나선의 형성을 결정하고 따라서 단백질의 2 차 구조를 결정합니다.
신진 대사에서 알라닌은 피루 베이트에서 트랜스 아 민화를 통해 합성됩니다. 피루 베이트는 신진 대사의 중간 산물입니다. 설탕, 지방산 또는 아미노산이 분해 될 때 생성됩니다. 추가로 분해되거나 추가 합성을위한 시작 물질로 다시 사용됩니다. 알라닌의 분해는 피루 베이트의 트랜스 아 민화에 대한 역반응으로 작용합니다. 효소 알라닌 탈수소 효소의 도움으로 알라닌은 다시 피루 베이트로 탈 아미 노화됩니다. 피루 베이트는 또한 빠르게 포도당으로 전환 될 수 있기 때문에 아미노산 대사와 탄수화물 대사 사이의 밀접한 관계가 명확 해집니다. 에너지가 갑자기 필요하면 잠시 저혈당증으로 이어질 수 있습니다. 이것은 간에서 알라닌의 탈 아미 노화와 피루 베이트의 포도당으로의 전환을 자극하는 스트레스 호르몬을 방출합니다.
이 과정은 혈당 수치를 일정하게 유지합니다. 이 사실 때문에 설탕 쇼크를 피하기 위해 저혈당증의 경우 알라닌 보충제가 종종 제공됩니다. 알라닌은 또한 면역 체계를 강화시키는 효과가 있습니다. 또한 신장 결석의 형성을 억제합니다. 알라닌은 근육 단백질의 필수 부분입니다. 근육 섬유에는 최대 6 %의 알라닌이 포함되어 있습니다. 근육을 분해하여 다시 방출됩니다.
혈중 알라닌의 30 %는 근육에서 나옵니다. 주요 대사 기관은 간입니다. 대부분의 알라닌 전환 반응은 간에서 발생합니다. 아미노산은 간 대사를 통해 인슐린 생산을 조절하는 효과가 있습니다. 전립선에 대한 충혈 제거 효과도 발견되었습니다.
교육, 발생, 속성 및 최적의 가치
육류 및 생선 제품에는 특히 고농도의 알라닌이 포함되어 있습니다. 버섯, 해바라기 씨, 콩가루, 밀 배아 또는 파슬리도 알라닌 함량이 높습니다. 일반적으로 체내에서 생성되는 알라닌의 양과 음식과 함께 섭취하는 양으로 충분합니다. 물에 대한 용해성으로 인해 알라닌은 물과 장기간 접촉하면 음식에서 씻겨 나갑니다.
이러한 이유로 알라닌이 풍부한 제품은 절대 오래 담 그거나 끓여서는 안됩니다. 결핍은 드뭅니다. 그러나 경쟁 스포츠에서 알라닌에 대한 필요성이 증가하여 단백질이 풍부한 식품이나 단백질 분말을 통한 추가 적용이 유용 할 수 있습니다. 어쨌든 훈련 성공은 알라닌에 의해 긍정적 인 영향을받습니다. 그것은 근육 섬유와 결합 조직 모두에서 고농도로 발견됩니다.
질병 및 장애
알라닌 결핍이 신체에 미치는 건강 영향은 거의 연구되지 않았습니다. 이러한 결핍은 일반적으로 극심한 영양 실조의 경우에만 발생할 수 있습니다. 그러나이 경우 더 이상 고립 된 알라닌 결핍이 없습니다.
알라닌은 일반적으로 음식과 신체 자체 생합성을 통해 신체에 충분히 이용 가능합니다. 알라닌 합성은 간에서 발생합니다. 알라닌 분해에도 동일하게 적용됩니다. 효소 알라닌 아미노 전이 효소는 간에서이를 위해 이용 가능합니다. Alanine aminotransferase는 transaminase이며 약어 GPT로 알려져 있습니다. GPT는 L- 알라닌의 알파-케 토글 루타 레이트로의 전환을 촉매합니다. 아미노 그룹은 L- 글루타메이트의 형성과 함께 알파-케 토글 루타 레이트로 전달됩니다. 피루 베이트는 알라닌에서 형성됩니다. 이러한 반응은 간 세포 내에서 발생합니다. 따라서 트랜스 아미나 아제는 혈액에서 낮은 농도로만 존재합니다.
혈액 내 효소 농도의 증가는 간 세포의 파괴를 나타냅니다. GPT (alanine aminotransferase 또는 new glutamate pyruvate transaminase) 외에도 다른 효소 값도 증가합니다. 이를 간 수치의 증가라고합니다. 간 가치의 도움으로 간 질환을 진단 할 수 있습니다. 간 질환의 첫 징후는 간 기능 검사의 증가 일 수 있습니다. 이것은 모든 형태의 간염, 간경변 또는 간암에 적용됩니다. 간 질환이 더 진행되면 장기는 더 이상 신진 대사 및 해독을위한 다양한 작업을 수행 할 수 없습니다.






.jpg)